
Fuvest - 1ª fase
Considere 4 frascos, cada um contendo diferentes substâncias, a saber:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HCl(aq), pôde-se observar aumento do valor do pH somente:
| a) |
nas soluções dos frascos 1, 2 e 4. |
| b) |
nas soluções dos frascos 1 e 3. |
| c) |
nas soluções dos frascos 2 e 4. |
| d) |
na solução do frasco 3. |
| e) |
na solução do frasco 4. |
Frasco 1: Antes da adição temos água pura, portanto o pH inicial é igual a 7,0 na temperatura ambiente. Ao fazer a adição de HCl o meio torna-se ácido havendo uma diminuição do pH.
Frasco 2: Antes da adição temos ácido acético, cujo pH inicial é menor do que 7,0, no entanto ao adicionar HCl ocorre uma diminuição do pH, porque esse ácido é mais forte (mais ionizado) que o ácido acético e foi adicionado em maior concentração que o ácido inicial.
Frasco 3: Antes da adição temos um meio alcalino devido ao KOH, com a adição do HCl em mesmo volume e concentração, ocorre a neutralização da base, formando-se uma solução salina de KCl, que é um sal neutro, portanto, de pH igual a 7,0, ou seja, neste caso também haverá diminuição do pH.
Frasco 4: Antes da adição o meio é ácido devido ao HNO3, com a adição de HCl ocorrerá um aumento de pH, porque o ácido adicionado tem a mesma força do ácido inicial, no entanto apresenta menor concentração. Sendo o volume de ambos iguais, a mistura resultará em uma solução ácida mais diluída (conforme cálculo abaixo), portanto de pH mais elevado.
Assim, somente no frasco 4 ocorrerá aumento do pH.
A figura abaixo traz um modelo da estrutura microscópica de determinada substância no estado sólido, estendendo-se pelas três dimensões do espaço. Nesse modelo, cada esfera representa um átomo e cada bastão, uma ligação química entre dois átomos.
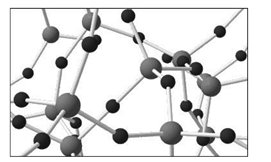
A substância representada por esse modelo tridimensional pode ser
| a) |
sílica, (SiO2)n. |
| b) |
diamante, C. |
| c) |
cloreto de sódio, NaCl. |
| d) |
zinco metálico, Zn. |
| e) |
celulose, (C6H10O5)n. |
A figura mostra um composto formado por apenas dois elementos diferentes, representados por uma esfera maior e uma esfera menor. Um dos elementos (representado pela esfera maior) faz quatro ligações, enquanto que o outro (representado pela esfera menor) faz duas ligações. Assim conclui-se que o composto é a sílica, já que o silício é da família 14 e, caracteristicamente, faz quatro ligações e o oxigênio é da família 16 e faz duas ligações.
b) Falsa. O Diamante é formado por apenas um elemento, mas a figura apresenta dois elementos diferentes.
c) Falsa. Na e Cl estão rodeados pelo mesmo número de átomos no retículo cristalino do NaCl (cada um deles apresenta número de coordenação igual a 6).
d) Falsa. O composto apresentado nesta alternativa apresenta apenas um elemento (o Zn).
e) Falsa. O composto desta alternativa apresenta três elementos (C, H e O).
Em um funil de separação, encontram-se, em contato, volumes iguais de duas soluções: uma solução aquosa de I2, de concentração 0,1 × 10-3 mol/L, e uma solução de I2 em CCl4, de concentração1,0 × 10-3 moI/L.
Considere que o valor da constante Kc do equilíbrio é igual a 100, à temperatura do experimento, para concentrações expressas em moI/L.
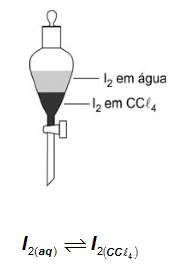
Assim sendo, o que é correto afirmar a respeito do sistema descrito?
| a) |
Se o sistema for agitado, o I2 será extraído do CCl4. pela água, até que a concentração de I2 em CCl4 se iguale a zero. |
| b) |
Se o sistema for agitado, o I2 será extraído da água pelo CCl4, até que a concentração de I2 em água se iguale a zero. |
| c) |
Mesmo se o sistema não for agitado, a concentração de I2 no CCl4 tenderá a aumentar e a de I2, na água, tenderá a diminuir, até que se atinja um estado de equilíbrio. |
| d) |
Mesmo se o sistema não for agitado, a concentração de I2 na água tenderá a aumentar e a de I2, no CCl4, tenderá a diminuir, até que se atinja um estado de equilíbrio. |
| e) |
Quer o sistema seja agitado ou não, ele já se encontra em equilíbrio e não haverá mudança nas concentrações de I2 nas duas fases. |
A partir dos dados presentes no enunciado é possível calcular o quociente de reação (Q) para verificar se o sistema encontra-se em equilíbrio.
Neste caso nota-se que Q < Kc, o que indica que o sistema não se encontra em equilíbrio e que a concentração de produtos (neste caso representado pelo I2 dissolvido em CCl4) no instante calculado é menor do que a concentração de produtos necessária para se atingir o equilíbrio. Sendo assim, I2 tende a migrar da fase aquosa para a fase orgânica para que o sistema atinja o equilíbrio.
a) Incorreta: a tendência é de migração do iodo da fase aquosa para a fase orgânica e como haverá um equilíbrio entre elas, a concentração em ambas as fases não poderá ser nula na situação de equilíbrio.
b) Incorreta: a tendência de migração está correta, mas a concentração em ambas as fases deve ser não nula ao se atingir a condição de equilíbrio.
c) Correta: independente da agitação, como as fases estão em contato, há tendência de migração do I2 da fase aquosa para fase orgânica até que se atinja o equilíbrio. O papel da agitação é apenas acelerar o processo, pois aumenta a superfície de contato entre as soluções.
d) Incorreta: a tendência de migração entre as fases está incorreta.
e) Incorreta: o sistema, conforme cálculo efetuado acima, não se encontra em equilíbrio.
Ao abastecer um automóvel com gasolina, é possível sentir o odor do combustível a certa distância da bomba. Isso significa que, no ar, existem moléculas dos componentes da gasolina, que são percebidas pelo olfato. Mesmo havendo, no ar, moléculas de combustível e de oxigênio, não há combustão nesse caso. Três explicações diferentes foram propostas para isso:
I. As moléculas dos componentes da gasolina e as do oxigênio estão em equilíbrio químico e, por isso, não reagem.
II. À temperatura ambiente, as moléculas dos componentes da gasolina e as do oxigênio não têm energia suficiente para iniciar a combustão.
III. As moléculas dos componentes da gasolina e as do oxigênio encontram-se tão separadas que não há colisão entre elas.
Dentre as explicações, está correto apenas o que se propõe em:
| a) |
I. |
| b) |
II. |
| c) |
III. |
| d) |
I e II. |
| e) |
II e III. |
I. Falsa, para que haja equilíbrio químico no sistema é preciso haver partículas dos reagentes (neste caso, “gasolina” e oxigênio) e partículas do produto (CO2 e H2O) coexistindo em um mesmo sistema fechado e com concentrações constantes ao longo do tempo. A atmosfera não pode ser considerada um sistema fechado e as quantidades das referidas substâncias não apresentam concentração constante ao longo do tempo neste sistema.
II. Verdadeira, mesmo sendo uma reação fortemente exotérmica, a combustão da gasolina necessita de certa energia para iniciar (energia de ativação), que não é atingida com as condições de temperatura ambiente (250C).
III. Falsa, as partículas que formam a gasolina estão dispersas pelo ar e podem facilmente colidir-se com o oxigênio, presente em cerca de 20% no ar atmosférico, desta forma há um número considerável de colisões entre as partículas que formam a gasolina e as de oxigênio presente no ar, porém, nas condições ambiente estas colisões não apresentam energia suficiente para a reação ocorrer.
O isótopo 14 do carbono emite radiação β, sendo que 1 g de carbono de um vegetal vivo apresenta cerca de 900 decaimentos β por hora – valor que permanece constante, pois as plantas absorvem continuamente novos átomos de 14C da atmosfera enquanto estão vivas. Uma ferramenta de madeira, recolhida num sítio arqueológico, apresentava 225 decaimentos β por hora por grama de carbono. Assim sendo, essa ferramenta deve datar, aproximadamente, de:
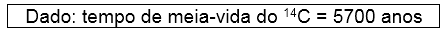
| a) |
19100 a.C. |
| b) |
17100 a.C. |
| c) |
9400 a.C. |
| d) |
7400 a.C. |
| e) |
3700 a.C. |
A velocidade de emissão de partículas alfa no vegetal vivo é de 900 desintegrações por hora. A partir do momento em que for cortada, a planta deixará de absorver carbono e a velocidade de decaimento diminuirá. Considerando a velocidade no tempo zero igual a 900 d/h, após 5700 anos (uma meia-vida) esse valor será de 450 d/h, e após 11400 anos (duas meias-vidas) esse valor será de 225 d/h.
Considerando que a ferramenta foi encontrada no ano de 2010 d.C., deve ter sido cortada em 9390 a.C.
As naves espaciais utilizam pilhas de combustível, alimentadas por oxigênio e hidrogênio, as quais, além de fornecerem a energia necessária para a operação das naves, produzem água, utilizada pelos tripulantes.
Essas pilhas usam, como eletrólito, o KOH(aq), de modo que todas as reações ocorrem em meio alcalino. A troca de elétrons se dá na superfície de um material poroso. Um esquema dessas pilhas, com o material poroso representado na cor cinza, é apresentado a seguir.
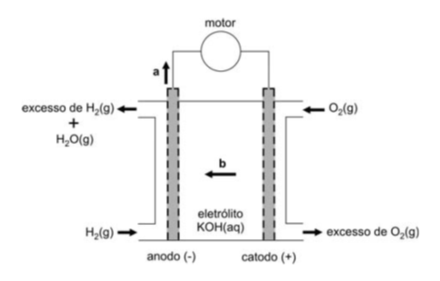
Escrevendo as equações das semirreações que ocorrem nessas pilhas de combustível, verifica-se que, nesse esquema, as setas com as letras a e b indicam, respectivamente, o sentido de movimento dos:
| a) |
íons OH- e dos elétrons. |
| b) |
elétrons e dos íons OH-. |
| c) |
íons K+ e dos elétrons. |
| d) |
elétrons e dos íons K+. |
| e) |
elétrons e dos íons H+. |
Ânodo:
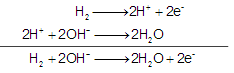
Cátodo:
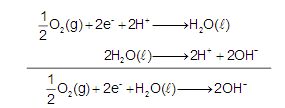
A seta a indica o tipo de partícula que passa do ânodo em direção ao cátodo. No ânodo, independente de termos uma pilha ou eletrólise, sempre ocorre o processo de oxidação (liberação de elétrons) e no cátodo sempre ocorre o processo de redução (absorção de elétrons), sendo assim a seta a indica o sentido do fluxo de elétrons do sistema representado.
A seta b indica o tipo de partícula que migra para o ânodo. Neste eletrodo houve perda de elétrons, tornando-o deficiente de cargas negativas. Para haver o equilíbrio de cargas, ocorrerá a migração de ânions do eletrólito para o ânodo para mantê-lo eletricamente neutro e o sistema funcionando. Sendo assim, a seta b indica o sentido do movimento dos íons OH-, ânions presentes no eletrólito.
Os confeitos de chocolate de determinada marca são apresentados em seis cores. Com eles, foi feito o seguinte experimento, destinado a separar os corantes utilizados em sua fabricação:
Confeitos de cada uma das seis diferentes cores foram umedecidos com água e pressionados contra uma folha de papel especial, de modo a deixar amostras dos corantes em pontos igualmente espaçados, sempre a 2 cm da base da folha. A seguir, a folha foi colocada em um recipiente com água, de forma a mergulhar somente a base da folha de papel na água, sem que o líquido tocasse os pontos coloridos.
Após algum tempo, quando a água havia atingido o topo da folha, observou-se a formação de manchas de diferentes cores, aqui simbolizadas por diferentes formas e tamanhos:
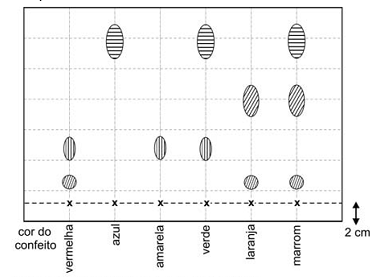
x indica o ponto de aplicação de cada amostra
Os confeitos em cuja fabricação é empregado um corante amarelo são os de cor:
| a) |
vermelha, amarela e marrom. |
| b) |
amarela, verde e laranja. |
| c) |
verde, azul e marrom. |
| d) |
vermelha, amarela e verde. |
| e) |
vermelha, laranja e marrom. |
De acordo com o enunciado e analisando a figura, é possível perceber que o corante amarelo é formado por apenas um tipo de pigmento, que aparece no formato de elipse com linhas verticais: 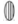
Pela simples observação do gráfico pode-se perceber que a representação do corante amarelo aparece também nos confeitos vermelho e verde, sendo portanto correta a alternativa D.
Para identificar quatro soluções aquosas, A, B, C e D, que podem ser soluções de hidróxido de sódio, sulfato de potássio, ácido sulfúrico e cloreto de bário, não necessariamente nessa ordem, foram efetuados três ensaios, descritos a seguir, com as respectivas observações.
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas a amostra de B se tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco solúveis em água, pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas de:
| a) |
H2SO4, NaOH, BaCl2 e K2SO4. |
| b) |
BaCl2, NaOH, K2SO4 e H2SO4. |
| c) |
NaOH, H2SO4, K2SO4 e BaCl2. |
| d) |
K2SO4, H2SO4, BaCl2 e NaOH. |
| e) |
H2SO4, NaOH, K2SO4 e BaCl2. |
(I) A fenolftaleína é um indicador ácido-base que fica rosada em meio básico e incolor em meio ácido. Das quatro substâncias citadas, apenas o NaOH torna a solução de fenolftaleína rosada por ser uma base. Assim conclui-se que a substância B é o NaOH.
(II) A adição da substância A no frasco contendo NaOH (substância B) torna a fenolftaleína incolor, ou seja, a substância A é um ácido. Das substâncias citadas a única de caráter ácido é o H2SO4.
(III) Amostras de A e C produzem precipitados brancos quando misturados com D. O precipitado citado é o BaSO4, formado na reação de compostos que contenham sulfato (A e C) com composto que contenha bário (D). As reações são mostradas a seguir:
H2SO4(aq) + BaCl2(aq) BaSO4(s) + 2 HCl(aq)
K2SO4(aq) + BaCl2(aq) BaSO4(s) + 2 KCl(aq)
Segue que a sustância C é K2SO4 e a substância D é BaCl2.
Em 2009, o mundo enfrentou uma epidemia, causada pelo vírus A(H1N1), que ficou conhecida como gripe suína. A descoberta do mecanismo de ação desse vírus permitiu o desenvolvimento de dois medicamentos para combater a infecção, por ele causada, e que continuam necessários, apesar de já existir e estar sendo aplicada a vacina contra esse vírus. As fórmulas estruturais dos princípios ativos desses medicamentos são:
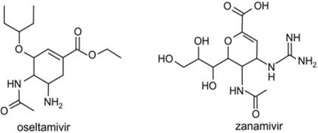
Examinando-se as fórmulas desses compostos, verifica-se que dois dos grupos funcionais que estão presentes no oseltamivir estão presentes também no zanamivir. Esses grupos são característicos de:
| a) |
amidas e éteres. |
| b) |
ésteres e álcoois. |
| c) |
ácidos carboxílicos e éteres. |
| d) |
ésteres e ácidos carboxílicos |
| e) |
amidas e álcoois. |
Explicitando as funções orgânicas dos compostos do enunciado, podemos facilmente responder à pergunta.
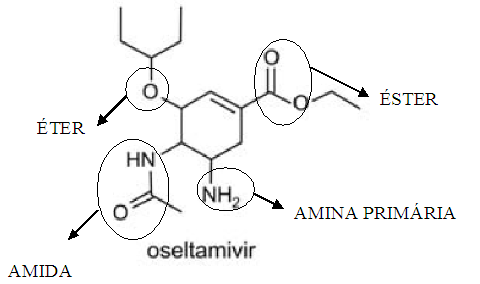
Figura: Funções orgânicas do oseltamivir.
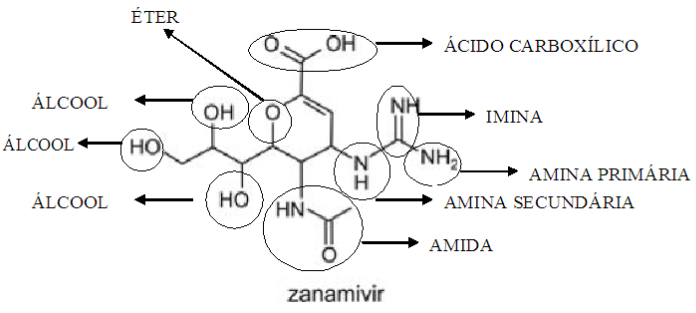
Figura: Funções orgânicas do zanamivir.
Assim, as funções em comum entre os dois compostos são amidas e éteres (entre outras).
A figura abaixo representa uma célula diploide e as células resultantes de sua divisão.
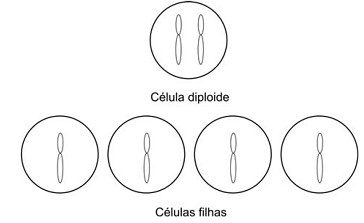
Nesse processo,
| a) |
houve um único período de síntese de DNA, seguido de uma única divisão celular. |
| b) |
houve um único período de síntese de DNA, seguido de duas divisões celulares. |
| c) |
houve dois períodos de síntese de DNA, seguidos de duas divisões celulares. |
| d) |
não pode ter ocorrido permutação cromossômica. |
| e) |
a quantidade de DNA das células filhas permaneceu igual à da célula mãe. |
A figura apresentada no enunciado se refere claramente a um processo de divisão meiótico. Isso pode ser depreendido da figura, pois ela apresenta, inicialmente, uma célula diplóide (2n = 2) e, como resultado do processo de divisão, quatro células haplóides (n = 1). Dessa forma, durante o ciclo celular, mais propriamente durante a fase S da interfase, ocorre a duplicação cromossômica, um único período de síntese de DNA a fim de duplicar as cromátides. Posteriormente, com o início da meiose, há dois processos de divisão celular: a meiose I, em que se observa a separação dos pares de homólogos, formando duas células já haplóides, embora com o cromossomo ainda duplicado – com duas cromátides; e a meiose II, na qual ocorre a separação das cromátides-irmãs, produzindo células com apenas uma cromátide, como as apontadas pela figura como células filhas.
a) Incorreta. A alternativa faz referência à ocorrência de apenas uma divisão celular.
b) Correta. De acordo com o exposto acima.
c) Incorreta. A alternativa indica que ocorrem dois processos de síntese de DNA. Só há um período de duplicação cromossômica em cada ciclo celular, mesmo para a meiose.
d) Incorreta. Permutação cromossômica, também conhecida como crossing over pode ocorrer em qualquer evento meiótico.
e) Incorreta. Há dois cromossomos na célula mãe representada na figura. Com isso, temos, nesta célula, duas moléculas de DNA. Já nas células filhas apresentadas, podemos observar um cromossomo e, portanto, há uma molécula de DNA por célula. A quantidade de DNA nas células mãe e filhas é diferente, portanto.