
Fuvest - 1ª fase
Os elementos químicos se relacionam de diferentes maneiras com os organismos vivos. Alguns elementos são parte da estrutura das moléculas que constituem os organismos vivos. Outros formam íons essenciais à manutenção da vida. Outros, ainda, podem representar riscos para os seres vivos: alguns, por serem tóxicos; outros, por serem radioativos.
Observe o esquema da Tabela Periódica, no qual estão destacados quatro elementos químicos, identificados pelas letras w, x, y e z.
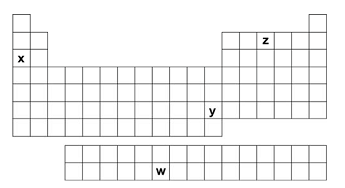
Considerando suas posições na Tabela Periódica, assinale a alternativa que melhor associa esses quatro elementos químicos, respectivamente com as propriedades discutidas acima:
| a) |
Elemento radioativo; íon essencial; metal tóxico; elemento estrutural.
|
| b) |
Metal tóxico; íon essencial; elemento estrutural; elemento radioativo.
|
| c) |
Elemento radioativo; elemento estrutural; íon essencial; metal tóxico.
|
| d) |
Elemento estrutural; elemento radioativo; íon essencial; metal tóxico.
|
| e) |
Elemento radioativo; metal tóxico; elemento estrutural; íon essencial.
|
O elemento w encontra-se na série dos actinídeos, sendo o sexto elemento desta série, localiza-se após o urânio (que é o quarto elemento desta série e último elemento natural). Então o elemento w é artificial e radioativo, por ter um núcleo bastante grande e instável. O elemento em questão é o plutônio (Pu) utilizado como combustível em bombas atômicas.
O elemento x encontra-se na família 1 e no 3º. Período, trata-se do sódio (Na) que na sua forma iônica é essencial para os organismos vivos, exercendo diferentes funções biológicas, como a bomba de sódio e potássio nos seres humanos, por exemplo.
O elemento y é um metal da família 12 e do 6º período. Trata-se de um metal pesado, no caso, mercúrio (Hg) que é reconhecidamente um metal tóxico.
O elemento z está localizado na família 15 (5A) e no 2º. Período. Trata-se do nitrogênio (N), que apresenta função estrutural por ser constituinte de substâncias orgânicas (estando presente, por exemplo, nas proteínas).
Na produção de combustível nuclear, o trióxido de urânio é transformado no hexafluoreto de urânio, como representado pelas equações químicas:
I.
II.
III.
Sobre tais transformações, pode-se afirmar, corretamente, que ocorre oxirredução apenas em
| a) |
I. |
| b) |
II. |
| c) |
III. |
| d) |
I e II. |
| e) |
I e III. |
A verificação se uma reação é ou não de oxi-redução pode ser feita simplesmente pelo cálculo do número de oxidação (NOX). Havendo variação no NOX em alguma espécie química presente, sendo uma de aumento e outra de redução do NOX têm-se uma reação REDOX. Isto ocorre nos itens I e III, conforme mostrado abaixo:
Os átomos de urânio sofreram redução (diminuição do NOX) e os átomos de hidrogênio sofreram oxidação (aumento do NOX).
Os átomos de urânio sofreram oxidação (aumento do NOX) e os átomos de flúor (da espécie F2) sofreram redução (diminuição do NOX).
As figuras a seguir representam, de maneira simplificada, as soluções aquosas de três ácidos, HA, HB e HC, de mesmas concentrações. As moléculas de água não estão representadas.
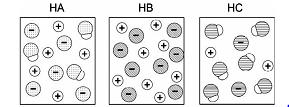
Considerando essas representações, foram feitas as seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior condutibilidade elétrica do que uma solução aquosa de mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do que uma solução aquosa de mesma concentração de HB.
Está correto o que se afirma em
| a) |
I, apenas. |
| b) |
I e II, apenas. |
| c) |
II e III, apenas. |
| d) |
I e III, apenas. |
| e) |
I, II e III. |
I. Correta. Pela figura é possível perceber que na solução do ácido HB as partículas estão completamente ionizadas, o que o caracteriza como um ácido forte. Já nas soluções dos ácidos HA e HC há espécies moleculares e iônicas em soluções, sendo portanto ácidos mais fracos (menor grau de ionização).
II. Correta. Também pela figura pode-se notar que a quantidade de íons em solução no frasco de HA é maior do que no frasco com HC. Com uma maior concentração de espécies portadoras de carga, a condutibilidade elétrica da solução de HA é maior que da solução HC.
III. Correta. A solução de HC tem menos íons livres que de HB, sendo assim a [H+] na solução de HC é menor do que em HB.
Como pH = -log[H+], têm-se:
E portanto observaremos um pH maior em HC do que em HB.
Uma estudante de química realizou quatro experimentos, que consistiram em misturar soluções aquosas de sais inorgânicos e observar os resultados. As observações foram anotadas em uma tabela:
| Experimento | Experimento Solutos contidos inicialmente nas soluções que foram misturadas | Observações | |
| 1 | Ba(ClO3)2 | Mg(IO3)2 | formação de precipitado branco |
| 2 | Mg(IO3)2 | Pb(ClO3)2 | formação de precipitado branco |
| 3 | MgCrO4 | Pb(ClO3)2 |
formação de precipitado amarelo |
| 4 | MgCrO4 | Ca(ClO3)2 |
nenhuma transformação observada |
A partir desses experimentos, conclui-se que são pouco solúveis em água somente os compostos
| a) |
Ba(IO3)2 e Mg(ClO3)2. |
| b) |
PbCrO4 e Mg(ClO3)2. |
| c) |
Pb(IO3)2 e CaCrO4. |
| d) |
Ba(IO3)2, Pb(IO3)2 e PbCrO4. |
| e) |
Pb(IO3)2, PbCrO4 e CaCrO4. |
Pela tabela fornecida, as reações ocorrem pela mistura de soluções salinas com formação de precipitado. Isso que ocorre devido a dupla troca de íons das soluções com formação de composto pouco solúvel
As possíveis reações são:
1) Ba(ClO3)2 + Mg(IO3)2 = Ba(IO3)2 + Mg(ClO3)2
2) Mg(IO3)2 + Pb(ClO3)2 = Pb(IO3)2 + Mg(ClO3)2
3) MgCrO4 + Pb(ClO3)2 = PbCrO4 + Mg(ClO3)2
4) MgCrO4 + Ca(ClO3)2 = CaCrO4 + Mg(ClO3)2
Segundo os dados, no experimento 4 não há alterações, o que indica que ambos os sais formados, CaCrO4 e Mg(ClO3)2, são muito solúveis. Como o Mg(ClO3)2 aparece também nas reações 1, 2 e 3 e, nestas, há precipitação, conclui-se que os precipitados são os outros sais formados, que são respectivamente Ba(IO3)2, Pb(IO3)2 e PbCrO4. Logo, conclui-se que estes sais são pouco solúveis.
Um estudante desejava estudar, experimentalmente, o efeito da temperatura sobre a velocidade de uma transformação química. Essa transformação pode ser representada por:

Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
| Número do Experimento | ||||
| 1 | 2 | 3 | 4 | |
| temperatura (ºC) | 15 | 20 | 30 | 10 |
| massa de catalisador (mg) | 1 | 2 | 3 | 4 |
| concentração inicial de A (mol/L) | 0,1 | 0,1 | 0,1 | 0,1 |
| concentração inicial de B (mol/L) | 0,2 | 0,2 | 0,2 | 0,2 |
| tempo decorrido até que a transformação se completasse (em segundos) | 47 | 15 | 4 | 18 |
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
| a) |
Manter as amostras à mesma temperatura em todos os experimentos.
|
| b) |
Manter iguais os tempos necessários para completar as transformações.
|
| c) |
Usar a mesma massa de catalisador em todos os experimentos.
|
| d) |
Aumentar a concentração dos reagentes A e B.
|
| e) |
Diminuir a concentração do reagente B.
|
Para se determinar a influência da temperatura na velocidade de uma reação deve-se manter as concentrações ou massas de reagentes e catalisador, pressão e demais condições constantes e variar apenas a temperatura. Medindo-se o tempo decorrido até que a reação termine, pode-se verificar qual o efeito da temperatura na reação, ou seja, qual reação apresenta maior ou menor velocidade.
Assim, deve-se manter todas as variáveis constantes com exceção da temperatura. Como para cada experimento, a massa do catalisador se alterou, para obter dados mais adequados ao objetivo proposto a mesma deveria ser mantida constante.
Sob condições adequadas, selênio (Se) e estanho (Sn) podem reagir, como representado pela equação
Em um experimento, deseja-se que haja reação completa, isto é, que os dois reagentes sejam totalmente consumidos. Sabendo-se que a massa molar do selênio (Se) é 2/3 da massa molar do estanho (Sn), a razão entre a massa de selênio e a massa de estanho ( : ), na reação, deve ser de:
| a) |
2 : 1 |
| b) |
3 : 2 |
| c) |
4 : 3 |
| d) |
2 : 3 |
| e) |
1 : 2 |
A proporção de selênio e estanho na reação é:
Podemos substituir nessa igualdade o número de mols por .
Como segundo o enunciado, MSe = 2/3 MSn, temos:
Em um experimento, alunos associaram os odores de alguns ésteres a aromas característicos de alimentos, como, por exemplo:
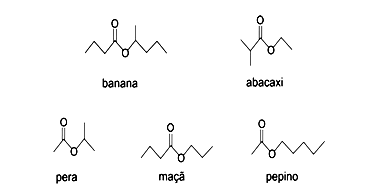
Analisando a fórmula estrutural dos ésteres apresentados, pode-se dizer que, dentre eles, os que têm cheiro de
| a) |
maçã e abacaxi são isômeros. |
| b) |
banana e pepino são preparados com alcoóis secundários. |
| c) |
pepino e maçã são heptanoatos. |
| d) |
pepino e pera são ésteres do mesmo ácido carboxílico. |
| e) |
pera e banana possuem, cada qual, um carbono assimétrico. |
a) Incorreta. O éster que tem cheiro de maçã (C7H14O2) e de abacaxi (C6H12O2) não têm a mesma fórmula molecular e portanto não podem ser isômeros.
b) Incorreta. O éster com cheiro de banana é preparado com álcool secundário (pentan-2-ol) e o com cheiro de pepino é preparado com álcool primário (pentan-1-ol)
c) Incorreta. O éster com cheiro de pepino é etanoato (preparado a partir de ácido etanóico) e o éster com cheiro de maçã é butanoato (preparado a partir de ácido butanóico)
d) Correta. Ambos são provenientes do ácido etanóico.
e) Incorreta. Apenas o éster que tem cheiro de banana apresenta carbono assimétrico (indicado pelo asterisco).
Do ponto de vista da “Química Verde”, as melhores transformações são aquelas em que não são gerados subprodutos. Mas, se forem gerados, os subprodutos não deverão ser agressivos ao ambiente.
Considere as seguintes transformações, representadas por equações químicas, em que, quando houver subprodutos, eles não estão indicados.
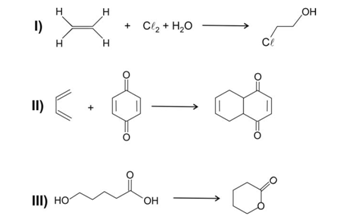
A ordem dessas transformações, da pior para a melhor, de acordo com a “Química Verde”, é:
| a) |
I, II, III. |
| b) |
I, III, II. |
| c) |
II, I, III. |
| d) |
II, III, I. |
| e) |
III, I, II. |
Na reação I o subproduto é HCl; na reação II não há subproduto e na III o subproduto é água (a reação é uma esterificação intramolecular).
Conforme o enunciado, as melhores transformações são aquelas que não geram subprodutos (como a II), mas se forem gerados, os subprodutos não deverão ser agressivos ao ambiente (como a III).
Assim, a ordem das transformações, da pior para a melhor é: I, III, II.
O “besouro bombardeiro” espanta seus predadores, expelindo uma solução quente. Quando ameaçado, em seu organismo ocorre a mistura de soluções aquosas de hidroquinona, peróxido de hidrogênio e enzimas, que promovem uma reação exotérmica, representada por:
O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
|
|
|
|
|
|
|
|
|
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é
| a) |
|
| b) |
|
| c) |
|
| d) |
|
| e) |
|
Aplicando-se a Lei de Hess é possível determinar o ∆H de uma reação a partir do somatório de reações cujo ∆H é conhecido. Sendo assim, têm-se:
Um botânico observou que uma mesma espécie de planta podia gerar flores azuis ou rosadas. Decidiu então estudar se a natureza do solo poderia influenciar a cor das flores. Para isso, fez alguns experimentos e anotou as seguintes observações:
I. Transplantada para um solo cujo pH era 5,6 , uma planta com flores rosadas passou a gerar flores azuis.
II. Ao adicionar um pouco de nitrato de sódio ao solo, em que estava a planta com flores azuis, a cor das flores permaneceu a mesma.
III. Ao adicionar calcário moído (CaCO3) ao solo, em que estava a planta com flores azuis, ela passou a gerar flores rosadas.
Considerando essas observações, o botânico pôde concluir que
| a) |
em um solo mais ácido do que aquele de pH 5,6, as flores da planta seriam azuis.
|
| b) |
a adição de solução diluída de NaCl ao solo, de pH 5,6 , faria a planta gerar flores rosadas.
|
| c) |
a adição de solução diluída de NaHCO3 ao solo, em que está a planta com flores rosadas, faria com que ela gerasse flores azuis.
|
| d) |
em um solo de pH 5,0 , a planta com flores azuis geraria flores rosadas.
|
| e) |
a adição de solução diluída de Al(NO3)3 ao solo, em que está uma planta com flores azuis, faria com que ela gerasse flores rosadas.
|
Pelo enunciado a mudança de cor das flores está relacionada ao pH, ou seja, ao caráter ácido-base do solo, o que pode ser atribuído ao fato do pigmento da flor comportar-se como um indicador ácido-base. Pelas observações pode-se dizer que:
I. pH = 5,6 (meio ácido) as flores se apresentam com cor AZUL.
II. Nitrato de sódio é um sal derivado de ácido e base fortes, portanto tem caráter neutro. Sendo assim, a adição de NaNO3 não altera o pH do solo pela adição de H+ ou OH- (e as flores continuam a apresentar cor AZUL). A pequena alteração de pH que pode acontecer é devido à diluição dos íons já presentes.
III. Em presença de CaCO3, que é um sal básico por ser derivado de ácido fraco e base forte, temos um meio com pH > 7,0 (básico) e a coloração torna-se ROSA.
Pode-se representar o equilíbrio a seguir:
H+ + Ind- = HInd
(rosa) (azul)
Sendo assim, conclui que a cor da flor será:
AZUL – meio ácido
ROSA - meio básico
a) Correta. Um solo com pH < 5,6 é ácido, o que gera flores com cor AZUL (forma a espécie HInd).
b) Errada. NaCl é um sal derivado de ácido e base fortes, de caráter neutro. O pH 5,6 do solo não sofreria alteração com a adição de uma solução diluída de NaCl (a não ser pela pequena alteração que pode acontecer é devido à diluição). Assim, seriam geradas flores com cor AZUL.
c) Errada. HCO3- consome H+ (formando um ácido fraco, o ácido carbônico que sofre decomposição em água e CO2). Dessa forma, desloca o equilíbrio formando a espécie Ind-, deixando as flores ROSA.
d) Errada. Um solo com pH = 5,0 é ácido e formaria a espécie HInd, deixando as flores com cor AZUL.
e) Errada. Al(NO3)3 é um sal ácido, pois é derivado de ácido forte e base fraca. Dessa forma, deixaria o meio ácido e faria com que a planta gere flores de cor AZUL.