
Fuvest - 1ª fase
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:
|
Solução |
Metal |
||
|
|
Pb |
Zn |
Fe |
|
Pb(NO3)2 (aq) |
(não) |
(sim) |
(sim) |
|
Zn(NO3)2 (aq) |
(não) |
(não) |
(não) |
|
Fe(NO3)2 (aq) |
(não) |
(sim) |
(não) |
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
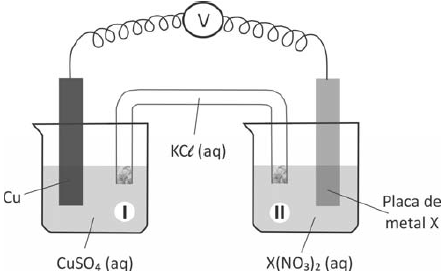
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq). Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a cada uma das pilhas, de acordo com a reatividade dos metais testados, deve ser (Metal X : Pb, Zn e Fe)
| a) |
a) Pb= 0,44; Zn= 1,07 e Fe= 0,75
|
| b) |
b) Pb= 0,44; Zn= 0,75 e Fe= 1,07
|
| c) |
c) Pb= 0,75; Zn= 0,44 e Fe= 1,07
|
| d) |
d) Pb= 0,75; Zn= 1,07 e Fe= 0,44
|
| e) |
e) Pb= 1,7 ; Zn= 0,44 e Fe= 0,75
|
Na pilha proposta, o metal X se oxida (ânodo) e o cobre (II) se reduz (cátodo):
Então, quanto maior o potencial de oxidação de X, maior será a força eletromotriz (fem) da pilha.
Como o Zn0 e o Fe0 reagem com o Pb+2, estes devem possuir um maior potencial de oxidação do que o chumbo.
Como o Zn0 reage com o Fe+2, ele deve possuir um maior potencial de oxidação do que o ferro.
Então, em termos de potencial de oxidação: Zn > Fe > Pb.
Logo, a ordem das “fem” das pilhas será dado por:
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).

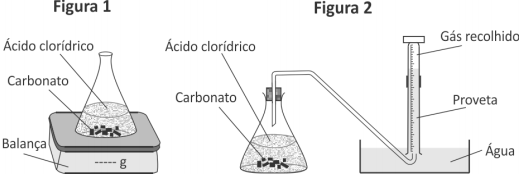
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
| a) |
0,14; 0,20 e 0,25
|
| b) |
0,14; 0,34 e 0,60
|
| c) |
0,34; 0,48 e 0,60
|
| d) |
0,34; 0,48 e 0,88
|
| e) |
0,62; 0,88 e 1,10
|
A redução da massa do sistema se deve a liberação do gás carbônico, que foi recolhido e teve seu volume medido na proveta. Logo, a massa de CO2(g) liberada ao longo do tempo será dada por:
A partir desses valores e da massa molar do CO2, podemos encontrar o número de mols de CO2(g) liberados ao longo do tempo:
Os volumes de CO2(g) podem ser calculados a partir do seu volume molar:
Nas mesmas condições de pressão e temperatura, 50 L de gás propano (C3H8) e 250 L de ar foram colocados em um reator, ao qual foi fornecida energia apenas suficiente para iniciar a reação de combustão. Após algum tempo, não mais se observou a liberação de calor, o que indicou que a reação havia se encerrado. Com base nessas observações experimentais, três afirmações foram feitas:
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator.
II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar.
III. É provável que, nessa combustão, tenha se formado fuligem.
Está correto apenas o que se afirma em

| a) |
I.
|
| b) |
III.
|
| c) |
I e II.
|
| d) |
I e III.
|
| e) |
e) II e III.
|
Vale se ressaltar que nas mesmas condições de temperatura e pressão, os volumes dos gases ideais passam a ser diretamente proporcionais ao número de mols, conforme demonstrado abaixo:
Cálculo da quantidade, em volume (V), de O2 presente no ar:
Afirmação I: Correta
A combustão incompleta, com a formação de monóxido de carbono (CO), do propano (C3H8) é apresentada abaixo:
Cálculo do volume (V1) de propano consumido na reação considerando as mesmas condições de temperatura e pressão:
O volume de propano que resta (
):
Afirmação II: Incorreta
A combustão completa do propano (C3H8) é apresentada abaixo:
Cálculo do volume (V2) de oxigênio necessário para o consumo de 50 L de propano (C3H8) nas mesmas condições de temperatura e pressão:
O volume de ar (Var) mínimo necessário no consumo de 250 L de O2 é:
Afirmação III: Correta
Como o propano está em excesso, como apresentado no item I, é possível que, na combustão incompleta, ocorra a formação de fuligem (C) como demonstrado abaixo:
Para aumentar o grau de conforto do motorista e contribuir para a segurança em dias chuvosos, alguns materiais podem ser aplicados no para-brisa do veículo, formando uma película que repele a água. Nesse tratamento, ocorre uma transformação na superfície do vidro, a qual pode ser representada pela seguinte equação química não balanceada:
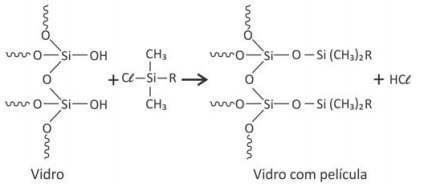
Das alternativas apresentadas, a que representa o melhor material a ser aplicado ao vidro, de forma a evitar o acúmulo de água, é:
Note e Adote:
R = grupo de átomos ligado ao átomo de silício
| a) |
Cl Si(CH3)2OH
|
| b) |
Cl Si(CH3)2O(CHOH)CH2NH2
|
| c) |
Cl Si(CH3)2O(CHOH)5CH3
|
| d) |
Cl Si(CH3)2OCH2(CH2)2CO2H
|
| e) |
Cl Si(CH3)2OCH2(CH2)10CH3
|
a) Incorreta. A presença do grupo hidrofílico OH (hidroxila) na película permite sua interação com a água, por ligações de hidrogênio.
b) Incorreta. A presença do grupo hidrofílico OH (hidroxila) e do grupo NH2 (amino) na película, permite sua interação com a água, por ligações de hidrogênio.
c) Incorreta. A presença dos diversos grupos hidrofílicos OH (hidroxila) na película permite sua interação com a água, por ligações de hidrogênio.
d) Incorreta. A presença do grupo hidrofílico CO2H (carboxila) na molécula permite a interação da película com a água, por ligações de hidrogênio.
e) Correta. A película de vidro apresenta um grupo alquil (dodecil), que é altamente hidrofóbico e, portanto, irá repelir as moléculas de água, evitando seu acúmulo sobre o vidro.
Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando, respectivamente, os haletos de hidrogênio HF e HCl, gasosos. Pode-se estimar a variação de entalpia (∆H) de cada uma dessas reações, utilizando-se dados de energia de ligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25 ºC e 1 atm.
|
Molécula |
H2 |
F2 |
Cl2 |
HF |
HCl |
|
Energia de ligação (kJ/mol) |
435 |
160 |
245 |
570 |
430 |
Com base nesses dados, um estudante calculou a variação de entalpia (∆H) de cada uma das reações e concluiu, corretamente, que, nas condições empregadas,
| a) |
a formação de HF (g) é a reação que libera mais energia.
|
| b) |
ambas as reações são endotérmicas.
|
| c) |
apenas a formação de HCl (g) é endotérmica.
|
| d) |
ambas as reações têm o mesmo valor de ∆H.
|
| e) |
apenas a formação de HCl (g) é exotérmica.
|
A entalpia de uma reação a partir das entalpias de ligação dos seus reagentes e produtos é dado pela seguinte forma:
Vale lembrar que ela tem essa forma, pois para que a reação ocorra é preciso quebrar as ligações existentes nos reagentes, que é sempre um processo endotérmico e formar novas ligações nos produtos, que é sempre um processo exotérmico.
A primeira reação é dada por:
Como a entalpia de uma reação é sempre dada por mol de produto formado, devemos calcular a entalpia da reação a partir da seguinte equação:
A segunda reação é dada por:
Novamente, como a entalpia de uma reação é sempre dada por mol de produto formado, devemos calcular a entalpia da reação a partir da seguinte equação:
Como demonstrado nos cálculos acima, ambas reações são exotérmicas, sendo que a reação de formação do HF(g) é a que libera maior energia.
Células a combustível são opções viáveis para gerar energia elétrica para motores e outros dispositivos. O esquema representa uma dessas células e as transformações que nela ocorrem.
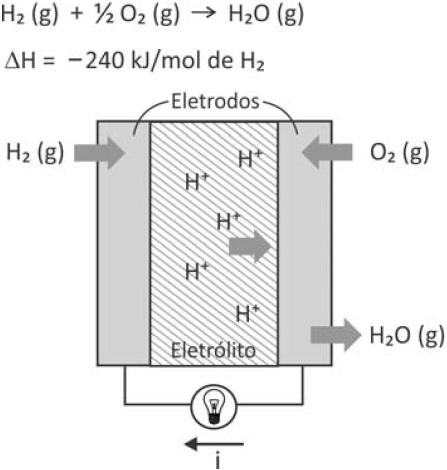
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo, é
Note a adote:
Carga de um mol de elétrons = 96500 Coulombs
| a) |
3,32.
|
| b) |
6,43.
|
| c) |
12,9.
|
| d) |
386.
|
| e) |
772.
|
A célula de combustível é um transdutor eletroquímico que converte energia química em energia elétrica, o qual apresenta algumas vantagens como a formação de água como produto e não de dióxido de carbono, monóxido de carbono ou fuligem quando comparamos com a queima de combustíveis fósseis, alem de trabalhar sob elevada eficiência energética. A célula de combustível apresenta o hidrogênio, como combustível, o qual é oxidado no ânodo e o oxigênio é reduzido no cátodo como indicado abaixo:
Cálculo da quantidade de matéria (n) de H2 gasoso equivalente a liberação de 4,80 KJ de energia:
Cálculo da carga (Q) referente à semirreação de oxidação de 0,02 mols de H2:
Cálculo da corrente elétrica (i) utilizando o tempo de 10 minutos ou 600 segundos utilizando a seguinte equação:
A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxi-hemoglobina (Hb(O2)n). Nos fetos, há um tipo de hemoglobina diferente da do adulto, chamada de hemoglobina fetal. O transporte de oxigênio pode ser representado pelo seguinte equilíbrio:
Hb + nO2 Hb(O2)n, em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal.
A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
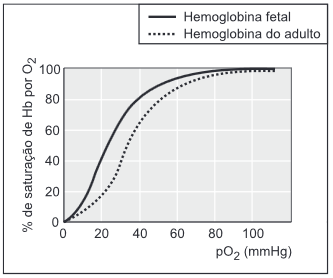
A porcentagem de saturação pode ser entendida como:
% de saturação = x 100
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
| a) |
I.
|
| b) |
II.
|
| c) |
I e II.
|
| d) |
I e III.
|
| e) |
II e III.
|
I) Correta. Na figura apresentada no enunciado pode se perceber que na pressão parcial de O2 de 30 mmHg, a % de saturação de Hb por O2 é maior no caso da hemoglobina fetal (acima de 60%) do que na hemoglobina do adulto (cerca de 40%). Isso indica que, para essa pressão parcial de oxigênio, no caso do feto, 60% de suas hemoglobinas estarão na forma de Hb(O2)n e, no caso do adulto, apenas 40% de suas hemoglobinas estarão na forma de Hb(O2)n.
II) Correta. Locais de grande altitude possuem uma menor pressão atmosférica em relação aos locais ao nível do mar, dessa forma, uma menor porcentagem das hemoglobinas de um adulto se encontrarão saturadas. Para corrigir esse problema, o organismo do adulto deve produzir mais hemoglobina para que o equilíbrio de associação do O2 pela hemoglobina seja deslocado para a direita (produto):
III) Incorreta. A concentração de hemoglobina associada ao oxigênio (Hb(O2)n) aumenta com a pressão parcial de oxigênio. Como a pressão parcial de oxigênio é maior no pulmão do que nos tecidos, a concentração de (Hb(O2)n) deve ser maior no pulmão do que nos tecidos.
A dopamina é um neurotransmissor importante em processos cerebrais. Uma das etapas de sua produção no organismo humano é a descarboxilação enzimática da L-Dopa, como esquematizado:
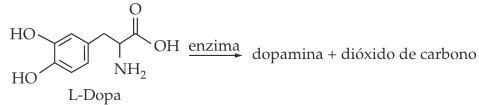
Sendo assim, a fórmula estrutural da dopamina é:
| a) |
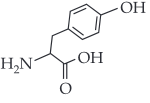 |
| b) |
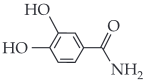 |
| c) |
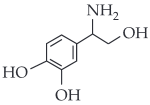 |
| d) |
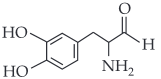 |
| e) |
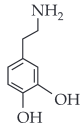 |
Ao se promover a descarboxilação da L-Dopa, a carboxila circulada em vermelho é removida resultando na dopamina, conforme a reação abaixo:
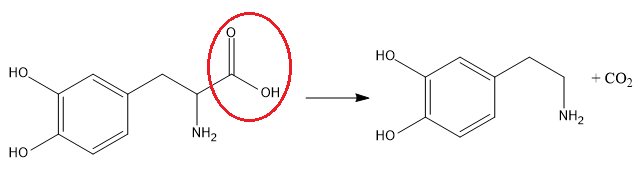
No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer.
Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200oC), alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a produção de dióxido de carbono pela adição de fermento à massa culinária são, apenas,
| a) |
I e II.
|
| b) |
II e III.
|
| c) |
III e IV.
|
| d) |
I, II e IV.
|
| e) |
I, III e IV.
|
I) Incorreta. Falsa, pois no fermento químico a reação não envolve os carboidratos da massa, mas apenas os componentes do fermento.
II) Correta. A reação de decomposição do fermenteo químico pe dado por:
III) Correta. As leveduras promovem a fermentação dos carboidratos produzindo CO2 e álcool (fermentação alcoólica).
IV) Incorreta. Em altas temperaturas (200 oC) as leveduras são destruídas, o que impossibilita o processo fermentativo.
Sejam e dois números inteiros positivos. Diz-se que e são equivalentes se a soma dos divisores positivos de coincide com a soma dos divisores positivos de . Constituem dois inteiros positivos equivalentes:
| a) |
8 e 9.
|
| b) |
9 e 11.
|
| c) |
10 e 12.
|
| d) |
15 e 20.
|
| e) |
16 e 25.
|
A respeito dos divisores positivos dos números apresentados no problema, temos:
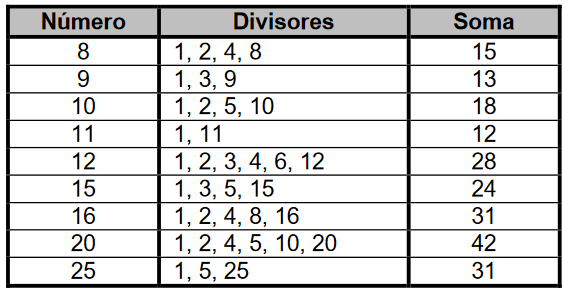
Como, segundo o exercício, dois números são equivalentes se a soma de seus divisores positivos for igual, resulta que:
- 8 e 9 não são equivalentes;
- 9 e 11 não são equivalentes;
- 10 e 12 não são equivalentes;
- 15 e 20 não são equivalentes;
- 16 e 25 são equivalentes.