
Unicamp - 2ª fase - Química e História
A cada quatro anos, durante os Jogos Olímpicos, bilhões de pessoas assistem à tentativa do Homem e da Ciência de superar limites. Podemos pensar no entretenimento, na geração de empregos, nos avanços da Ciência do Desporto e da tecnologia em geral. Como esses jogos podem ser analisados do ponto de vista da Química? As questões a seguir são exemplos de como o conhecimento químico é ou pode ser usado nesse contexto.
Nos Jogos Olímpicos de Beijing houve uma preocupação em se evitar a ocorrência de chuvas durante a cerimônia de abertura. Utilizou-se o iodeto de prata no bombardeamento de nuvens nas vizinhanças da cidade para provocar chuva nesses locais e, assim, evitá-la no Estádio Olímpico. O iodeto de prata tem uma estrutura cristalina similar à do gelo, o que induz a formação de gelo e chuva sob condições específicas.
a) Sobre a estratégia utilizada em Beijing, veiculou-se na imprensa que “o método não altera a composição da água da chuva”. Responda se essa afirmação é correta ou não e justifique.
b) Escreva a expressão da constante do produto de solubilidade do iodeto de prata e calcule sua concentração em mol L-1 numa solução aquosa saturada a 25 ºC.
Dado: A constante do produto de solubilidade do iodeto de prata é
a) A afirmação pode ser considerada correta se considerarmos o termo “água da chuva” como tudo aquilo que efetivamente se dissolve em água. Como o iodeto de prata (AgI) é um sal pouquíssimo solúvel em água (KPS = 8,3 x 10-17 a 25 ºC) e o seu bombardeamento em nuvens não provocaria alteração significativa na composição da água da chuva. Entretanto, a afirmação pode ser considerada como incorreta ao se considerar o termo “água da chuva” como tudo aquilo que se precipitaria. Apesar do sal ser pouco solúvel em água, ele acaba se precipitando junto com a chuva (formando uma mistura heterogênea).
b) 9.10-9 mol/L
Fogos de artifício foram utilizados na abertura e no encerramento da Olimpíada de Beijing. Um dos principais efeitos visuais desses fogos é a cor emitida. Freqüentemente, a substância responsável pela coloração é um sólido iônico contendo um íon de metal alcalino ou alcalino terroso. O sal, a partir da explosão, recebe energia e sofre várias transformações. Inicialmente o sal passa para o estado gasoso, com a posterior separação dos íons. Depois, esses íons no estado gasoso se transformam em espécies neutras, sendo as espécies neutras provenientes dos cátions as responsáveis pelo efeito visual.
a) Equacione a seqüência de transformações que o cloreto de bário sofreria em fogos de artifício, conforme descrito em itálico no texto.
b) Observaram-se várias cores na queima de fogos na abertura dos Jogos Olímpicos, entre elas a alaranjada (mistura de amarelo e vermelho). Suponha que alguém explicasse que essa cor foi obtida pelo uso do composto iônico Na2Sr. De acordo com o conhecimento químico e as informações dadas, essa explicação seria correta ou não? Justifique.
Dados:
|
Elemento |
sódio |
estrôncio |
|
Cor da emissão |
amarelo |
vermelho |
a) As transformações são as seguintes:
b) Esta explicação seria incorreta, pois o composto Na2Sr não teria caráter iônico por ser formado por um metal alcalino e um metal alcalino terroso. Para que um composto possua caráter iônico ele tipicamente é formado por um metal e um ametal. A diferença entre as eletronegatividades é pequena e portanto essa hipótese é descartada.
Além disso, no caso improvável de formação de um composto iônico, apenas um deles emitiria a cor indicada no enunciado. Isso ocorre devido à cor da emissão (associada à transição dos elétrons) serem relativas aos cátions Na+ e Sr2+. Apesar de improvável (devido à pequena diferença de eletronegatividade), um eventual composto iônico da forma Na2Sr apresentaria um dos elementos se comportando como ânion, tendo um espectro de emissão distinto.
Se e , o valor de é:
| a) |
17 |
| b) |
18 |
| c) |
29 |
| d) |
30 |
| e) |
31 |
Ao contrário do que muitos pensam, a medalha de ouro da Olimpíada de Beijing é feita de prata, sendo apenas recoberta com uma fina camada de ouro obtida por deposição eletrolítica. Na eletrólise, a medalha cunhada em prata atua como o eletrodo em que o ouro se deposita. A solução eletrolítica é constituída de um sal de ouro (III). A quantidade de ouro depositada em cada medalha é de 6,0 gramas.
a) Supondo que o processo de eletrólise tenha sido conduzido em uma solução aquosa de ouro (III) contendo excesso de íons cloreto em meio ácido, equacione a reação total do processo eletroquímico. Considere que no anodo forma-se o gás cloro.
b) Supondo que tenha sido utilizada uma corrente elétrica constante de 2,5 amperes no processo eletrolítico, quanto tempo (em minutos) foi gasto para se fazer a deposição do ouro em uma medalha? Mostre os cálculos.
Dados: constante de Faraday = 96.500 coulomb mol-1; 1 ampere = 1 coulomb s-1.
a)
b) 58,8 min
As provas de natação da Olimpíada de Beijing foram realizadas no complexo aquático denominado “Water Cube”. O volume de água de 16.000 m3 desse conjunto passa por um duplo sistema de filtração e recebe um tratamento de desinfecção, o que permite a recuperação quase total da água. Além disso, um sistema de ventilação permite a eliminação de traços de aromas das superfícies aquáticas.
a) O texto acima relata um processo de separação de misturas. Dê o nome desse processo e explique que tipo de mistura ele permite separar.
b) A desinfecção da água é realizada por sete máquinas que transformam o gás oxigênio puro em ozônio. Cada máquina é capaz de produzir cerca de 240 g de ozônio por hora. Considerando-se essas informações, qual a massa de gás oxigênio consumida por hora no tratamento da água do complexo?
a) Há dois processos relatados:
I - Filtração: pode ser utilizado para a separação de misturas heterogêneas que contenham os estados sólido e líquido ou sólido e gasoso.
II – Ventilação: usado na separação de traços de aromas (estado gasoso) das superfícies aquáticas utilizando corrente de ar. Este processo também é utilizado na separação de dois sólidos de densidades diferentes.
b) A equação para transformação do gás oxigênio em ozônio é dada abaixo:
Como ambos os gases são formados por átomos de oxigênio considerando que nesta transformação há conservação total dos átomos, a massa de oxigênio consumido é igual a massa de ozônio produzido (Lei de Lavoisier). Há então um consumo de 240 g de O2 por hora para a produção de 240 g de O3 por hora em cada máquina.
Como no complexo são utilizadas sete máquinas a massa de oxigênio consumida é: 240 g x 7 = 1680 g
O gás ozônio, empregado como biocida, foi muito utilizado na Olimpíada de Beijing na desinfecção da água do complexo “Water Cube”. Sua estabilidade química depende de alguns fatores, conforme se observa na tabela abaixo. Consta que a temperatura da água das piscinas desse complexo foi mantida a 28 ºC para melhorar o desempenho dos atletas, enquanto o ambiente era mantido a 20 ºC.
a) Considere que, como medida preventiva, parte do gás ozônio fosse produzida com certa antecedência e estocada em botijões dentro do próprio prédio, para ser utilizada em uma emergência. De acordo com os dados fornecidos, depois de quanto tempo a concentração desse gás dentro dos botijões seria igual a 1/8 da concentração de quando o botijão foi preenchido? Justifique sua resposta.
b) A partir dos dados da tabela, o que se pode afirmar sobre a estabilidade do ozônio?
Dados:
|
Ozônio em fase gasosa |
Ozônio dissolvido em água |
||
|
Temperatura / °C |
|
Temperatura / °C |
|
|
-50 |
3 meses |
15 |
30 min. |
|
-35 |
18 dias |
20 |
20 min. |
|
-25 |
8 dias |
25 |
15 min. |
|
20 |
2 dias |
30 |
12 min. |
|
120 |
1,5 horas |
35 |
8 min. |
– tempo de meia vida
a) 6 dias.
b) I. O ozônio é mais estável em fase gasosa do que dissolvido em água; considerando uma mesma temperatura (20 °C) o tempo de meia vida do ozônio em fase gasosa é maior.
II. Quanto menor for a temperatura, maior será a estabilidade do ozônio; o ozônio apresenta tempos de meia vida maiores em temperaturas menores, tanto em fase gasosa quanto dissolvido em água.
A figura abaixo mostra a solubilidade do gás ozônio em água em função da temperatura. Esses dados são válidos para uma pressão parcial de 3.000 Pa do gás em contato com a água. A solubilização em água, nesse caso, pode ser representada pela equação:
a) Esboce, na figura apresentada abaixo, um possível gráfico de solubilidade do ozônio, considerando, agora, uma pressão parcial igual a 5.000 Pa. Justifique.
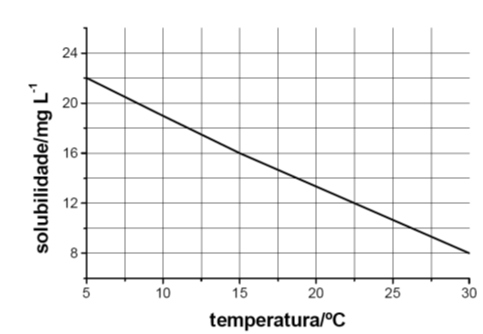
b) Considerando que o comportamento da dissolução, apresentado na figura abaixo, seja válido para outros valores de temperatura, determine a que temperatura a solubilidade do gás ozônio em água seria nula. Mostre como obteve o resultado.
a) Segundo a Lei de Henry, a solubilidade de um gás é diretamente proporcional à sua pressão parcial.
O gráfico correspondente a essa nova reta, agora à pressão de 5000 Pa, é representado na figura a seguir.
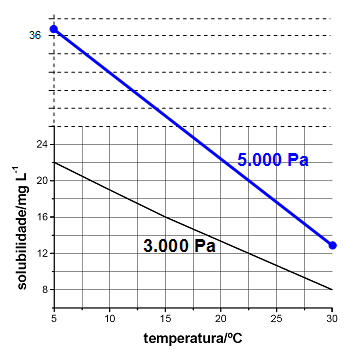
b) 44,3ºC
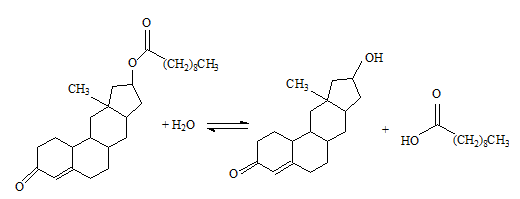
Um dos pontos mais polêmicos na Olimpíada de Beijing foi o doping. Durante os jogos foram feitos aproximadamente 4.600 testes, entre urinários e sanguíneos, com alguns casos de doping confirmados. O último a ser flagrado foi um halterofilista ucraniano, cujo teste de urina foi positivo para nandrolona, um esteróide anabolizante. Esse esteróide é comercializado na forma decanoato de nandrolona (I), que sofre hidrólise, liberando a nandrolona no organismo.
a) Na estrutura I, identifique com um círculo e nomeie os grupos funcionais presentes.
b) Complete a equação química da reação de hidrólise do decanoato de nandrolona, partindo da estrutura fornecida.
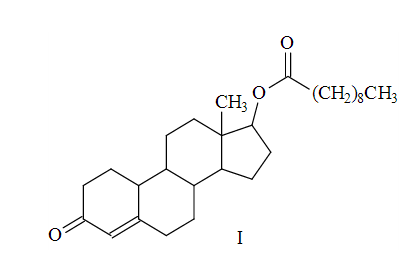
a)
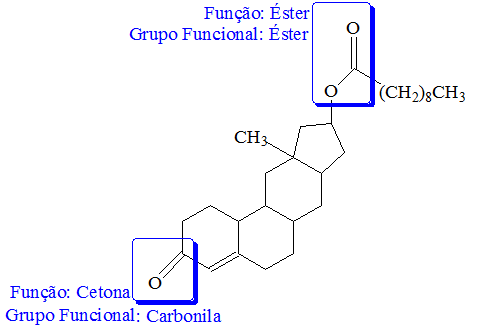
b) A hidrólise do éster (no caso, o decanoato de nandrolona) produzirá um álcool e um ácido carboxílico conforme o esquema abaixo:
O nadador Michael Phelps surgiu na Olimpíada de Beijing como um verdadeiro fenômeno, tanto pelo seu desempenho quanto pelo seu consumo alimentar. Divulgou-se que ele ingere uma quantidade diária de alimentos capaz de lhe oferecer uma energia de 50 MJ. Quanto disto é assimilado, ou não, é uma incógnita. Só no almoço, ele ingere um pacote de macarrão de 500 gramas, além de acompanhamentos.
a) Suponha que o macarrão seja constituído essencialmente de glicose (C6H12O6), e que, no metabolismo, toda essa glicose seja transformada em dióxido de carbono e água. Considerando-se apenas o metabolismo do macarrão diário, qual é a contribuição do nadador para o efeito estufa, em gramas de dióxido de carbono?
b) Qual é a quantidade de energia, em kJ, associada à combustão completa e total do macarrão (glicose) ingerido diariamente pelo nadador?
Dados de entalpia de formação em kJ mol-1: glicose = -1.274, água = -242, dióxido de carbono = -394.
a)
b)
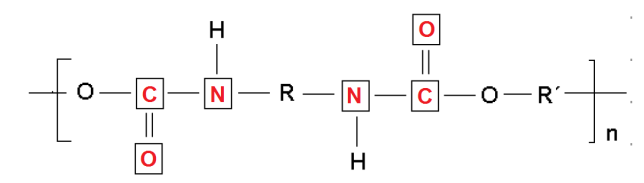
Um maiô produzido com material polimérico foi utilizado pela maioria dos competidores de natação em Beijing. Afirma-se que ele oferece uma série de vantagens para o desempenho dos nadadores: redução de atrito, flutuabilidade, baixa absorção de água, ajuste da simetria corporal e melhoria de circulação sanguínea, entre outras. O tecido do maiô é um misto de náilon e elastano, esse último, um copolímero de poliuretano e polietilenoglicol.
a) A cadeia do poliuretano a que se refere o texto está parcialmente representada abaixo. Preencha os quadrados com símbolos atômicos, selecionados entre os seguintes: H, F, U, C, N, O, Sn.
b) O náilon, que também forma o tecido do maiô, pode ser obtido por reações entre diaminas e ácidos dicarboxílicos, sendo a mais comum a reação de hexametilenodiamina e ácido adípico. De acordo com essas informações, seria possível utilizar o ácido lático, citado na questão nº 3, para se preparar algum tipo de náilon? Justifique.
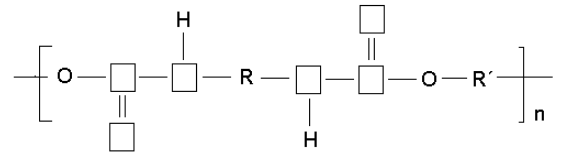
a)
b) O ácido lático citado na questão nº 3, de fórmula CH3CH(OH)COOH, não pode ser utilizado para se preparar algum tipo de náilon pois não se trata de um ácido dicarboxílico, ou seja, um ácido carboxílico com dois grupos carboxilas, o que é necessário na preparação conforme descrição do enunciado.