Questão 8 Específicas
Um professor de química realizou com seus alunos um experimento utilizando tubos de ensaio, balões de borracha, solução de peróxido de hidrogênio e iodeto de potássio. Em cada um dos tubos de ensaio foram colocados 11,3 g de solução de peróxido de hidrogênio, e somente em um deles foi adicionado o catalisador iodeto de potássio. Em seguida, os balões de borracha foram fixados, simultaneamente, nas bocas dos dois tubos. Após determinado tempo, observou-se um aumento de temperatura em ambos os tubos, mas os volumes coletados de gás foram bem diferentes, conforme mostram as figuras.
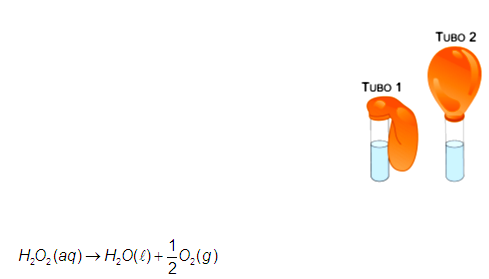
a) Considerando que a reação no tubo 2 foi completa, que o volume de gás coletado no balão de borracha foi de 1,2 L a 300 K e 1 atm, e utilizando R = 0,08 atm.L.K-1.mol-1 , calcule o teor percentual de H2O2 em massa presente na solução de peróxido de hidrogênio.
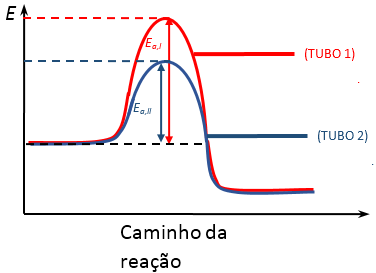
b) No gráfico contido no campo de Resolução e Resposta, trace duas curvas, uma referente à reação ocorrida no tubo 1 e a outra referente à reação ocorrida no tubo 2. Identifique as curvas.
a) I) Cálculo do número de mol do gás oxigênio produzido:
A partir da equação de estado de um gás ideal (), é possível o cálculo do número de mol de O2..
II) Cálculo do teor percentual de H2O2:

X = 3,4 gramas de H2O2
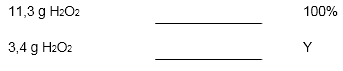
Y = 30,08% de H2O2
b) A partir do gráfico abaixo, pode-se verificar que a curva com a menor energia de ativação (E.a.II) corresponde ao experimento realizado na presença de um catalisador (KI), o que faz com que a reação ocorra com maior velocidade.
A curva I, corresponde ao experimento realizado na ausência do catalisador (KI), maior energia de ativação (E.a.I) e consequentemente uma menor velocidade de reação.