
Questão 6 Específicas
O sulfato de cobre (II) hidratado, CuSO4.xH2O, é um composto utilizado como fungicida na agricultura, principalmente na cultura de frutas como uva e figo. Para compreender as ligações químicas predominantes nesse composto e o seu grau de hidratação, foram realizados dois experimentos.
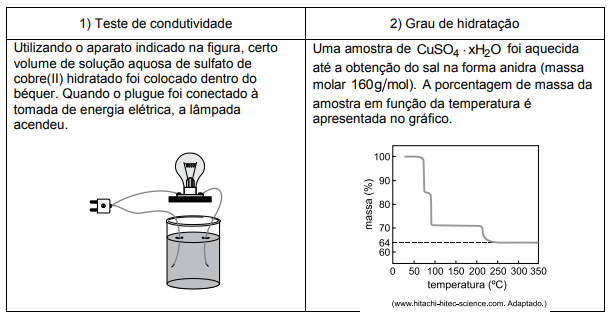
a) Que tipo de ligação química no sulfato de cobre (II) pode ser explicada pelo resultado do teste de condutividade? Justifique sua resposta.
b) A partir do gráfico, determine o número (x) de moléculas de água no sal . Apresente os cálculos efetuados
a) A ligação presente no sulfato de cobre (II) é a iônica.
Sabe-se que os compostos iônicos, quando fundidos ou em solução aquosa, sofrem dissociação fazendo com que existam íons livres em solução aquosa, o que justifica o teste de condutividade ser positivo, como mostrado no esquema abaixo.
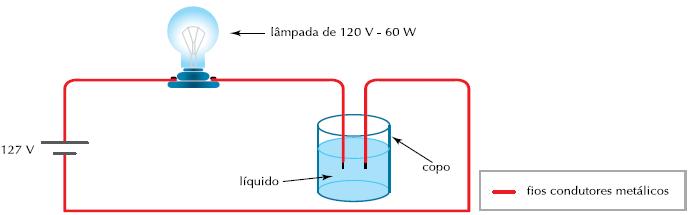
http://www.revista.vestibular.uerj.br/lib/spaw2/uploads/images/q_22_2ex_2009.JPG
b) A partir da análise do gráfico fornecido, nota-se que próximo da temperatura de 250ºC, ocorre a perda total de água, o que equivale a 36% de perda de massa, atribuída à perda das moléculas de água do sal hidratado.
Cálculo da massa molar do sal hidratado:
M = [63,5g/mol + 32,1g/mol + 4 ⋅ (16g/mol) + x ⋅ 18g] g/mol
M = (159,6 + 18 x) g/mol
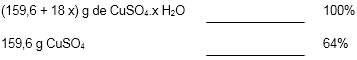
x = 4,99 mol de H2O
Portanto, o valor de x é igual a aproximadamente 5, assim, trata-se do sulfato de cobre (II) pentaidratado (CuSO4 . 5 H2O).